Por la
Dra. Liliana D´Agostino:
Interpretación de la electroforesis de proteínas séricas
La electroforesis de proteínas séricas
es ampliamente utilizada en los laboratorios de análisis clínicos,
aunque la información que puede obtenerse de la observación
e interpretación del trazado electroforético no es suficientemente
aprovechada.
La concentración de las proteínas totales y la proporción
de las distintas fracciones proteicas varía según distintas
situaciones clínicas, por lo tanto la determinación cuali-cuantitativa
de las distintas fracciones proteicas constituye un aporte valioso al
diagnóstico.
La electroforesis constituye una técnica simple para separar las
proteínas del suero. Se utiliza la electroforesis de zona en la
cual se emplea un soporte inerte: acetato de celulosa, agarosa o el interior
de capilares con buffer (electroforesis capilar). Las proteínas
son moléculas anfóteras y es posible elegir un buffer en
cual adquieran carga neta, al aplicar un campo eléctrico se facilita
la separación, migran hacia el ánodo y aquellas con carga
débilmente negativa migran hacia el cátodo una vez completada
la electroforesis por el flujo endosmótico creado por los cationes
del buffer.
Luego de realizada la electroforesis se realiza la coloración de
las proteínas, previa fijación en los sistemas basados en
gel, con Amidoschwartz 10 B, Ponceau S o Azul de Coomassie. Es importante
lograr una buena decoloración, esto se logra en general con tres
lavados con solución decolorante, luego se seca y se lee en el
densitómetro para cuantificar las fracciones proteicas separadas
por electroforesis.
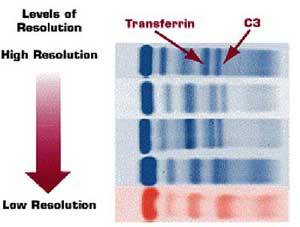
Técnicas de baja resolución:
Son aquellas que permiten separar 5 bandas en el patrón electroforético.
No puede visualizarse con precisión la fracción Beta-1 (transferrina
y Beta-2(C3). No resulta adecuado para la detección de gammopatías
monoclonales (M) pequeñas y gammopatías monoclonales en
la fracción Beta.
Técnicas de alta resolución:
Permiten una separación definida entre Beta-1 y Beta-2, además
permite detectar proteínas monoclonales que migran en la fracción
beta y también proteínas M que migran en alfa-2 y naturalmente
en la región gamma también.
Algunos sistemas llegan a separar de 10 a 12 fracciones proteicas: prealbúmina,
albúmina, alfa-lipoproteína, a1-glicoproteína ácida,
a1-antitripsina, a2-macroglobulina, haptoglobina, transferían,
beta lipoproteína, C3, fibrinógeno, proteína C-reactiva
(sí está aumentada) y gamma globulina (representada mayormente
por IgG). Con fines prácticos muchas de estas proteínas
no se observan como bandas discretas y están presentes en pequeñas
concentración, por lo que habitualmente se escanean 5 o 6 regiones
con el densitómetro.
En la figura 1
se muestran corridas electroforéticas con distintos niveles de
resolución:
 Figura
1.- Figura
1.-
Consideraciones a tener en cuenta en el momento de interpretar
un proteinograma:
1- La visualización
del gel es el medio más sensible de detección, especialmente
de componentes M de baja concentración que pueden pasar inadvertidos
en l densitometría.
2- Un decrecimiento
de albúmina, acompañado de incremento de a1- y a2- globulinas
pueden presentarse en infecciones, inflamaciones por diversos orígenes.
3- La disminución
de a1-globulina se debe generalmente a un déficit de a1-antitripsina.
4- ß1-globulina
aumentada a expensas de la transferían en pacientes con anemia
ferropénica.
5- Fibrinógeno
si en lugar de suero se utiliza plasma o en pacientes anticoagulados,
aparece como una banda discreta ente Beta y Gamma que
puede ser indistinguible de una proteína M.
6- En el síndrome
nefrótico se produce una disminución de albúmina
y gamma-globulinas con aumento de a2 y a-globulinas
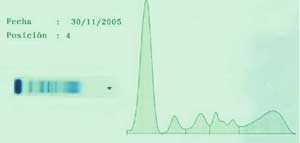
7- La Beta lipoproteína
migra con contorno irregular desde alfa2 hasta beta-2, como está
indicada en la flecha de la figura 2
 Figura
2.- Figura
2.-
8- Un aumento
policlonal de Igs se observa como una banda ancha limitada a la región
g, como también puede apreciarse en la figura
2
9- En la región
a2 habitualmente se superponen a2-macroglobulina y haptoglobina como para
distinguirlas, se debe prestar atención a la presencia de hemólisis
en el suero ya que pueden formarse complejo Hb-Hp en la región
a2 y confundir con un pico M en la región a2.
10- La hipogammaglobulinemia
se
considera por debajo de 0,6 g/dl
y se visualiza como una disminución de la fracción ã
y debe confirmarse con el dopaje cuantitativo de IgG, IgA e IgM.
Control de Calidad en la separación
electroforética
de proteínas séricas:
Debe cubrir 3 aspectos fundamentales:
1-Calidad de resolución de la técnica
de separación electroforética.
2-Calidad del informe.
3-Capacidad para detectar
bandas anormales.
1- El laboratorio debe evaluar el soporte,
coloración, método de evaluación que se adapte a
sus requerimientos y disponibilidades.
2- El informe no sólo debe proveer un resultado
numérico si no también la interpretación, para lo
que es indispensable el contacto entre el médico y el laboratorio,
sobre todo ante la aparición de una banda inesperada o discrepancias
en los resultados.
3- El punto 3 está muy ligado al primero.
El PEEC viene realizando encuestas de evaluación
de calidad en electroforesis de proteínas séricas en las
que no se incluyeron aún componentes M que permitan detectar la
sensibilidad de los sistemas que se utilizan en los distintos laboratorios
participantes.
En una encuesta realizada por el Colegio de Patólogos Americanos
en 1991; el 96.2% de los laboratorios que utilizaron sistemas de alta
resolución fueron capaces de detectar una proteína M de
baja concentración pero evidente; para los laboratorios que utilizaron
distintos sistemas de baja resolución el porcentaje de respuestas
correctas varió entre 28 a 66% (College of American Pathologists
SURVEY Report EC-07,1991).
Los laboratorios deben implementar un control de calidad interno no sólo
para evaluar el comportamiento analítico si no también la
interpretación de la corrida electroforética para lo que
es clave el conocimiento de la historia clínica del paciente.
Bibliografía:
1-“Inmunología e Inmunoquímica”, Ricardo
Margni, 4° edición, editorial Panamericana.
2-Understanding and Identifying Monoclonal Gammopathies
Mohammed Attaelmannan and Stanley S. Levinson, Clin Chem 46:8(B), 1230-1238
(2000)
3-Sequence of Testing for Monoclonal Gammopathies Serum
and Urine Assays. Robert A. Kyle, MD Arch Pathol Lab Med.1999;123:114–118
4-Procedures for the Evaluation of Monoclonal Immunoglobulins.
David F. Keren, MD. Arch Pathol Lab Med. 1999;123:126–132
|